|
最近,以韩春雨为首的团队发现了首个“中国创造”尖端基因编辑技术NgAgo-gDNA,该技术被誉为第四代基因编辑技术,打破了国外基因编辑技术的专利垄断,达到了国际一流水平,有业内人士称其有可能超越CRISPR-Cas9技术,但除了技术的先进性,我们或许也需要关注技术侧面的一些问题。
从韩春雨诺奖级项目说起:谈专利的重要性
文/科学网博客 沙晨
近几天,韩春雨副教授在Nature Biotech发表重大原创成果的报道抢占了很多媒体的头条,让众人称赞。很多研究人员认为韩春雨报道的NgAgo-gDNA技术更适合人类基因组编辑,将有可能超越CRISPR-Cas9技术。出于专业兴趣,作者检索了韩春雨的专利,发现了一些问题,在此提出来供研究人员参考。
韩春雨和John van der Oost都在nature发表了论文
先看一下韩春雨从产生研究想法到《Nature Biotech》报道其研究成果的整个过程。
韩春雨对NgAgo的研究受Wageningen University(荷兰)的范德欧斯特研究组(John van der Oost)在《Nature》杂志上发表的文章《DNA-guided DNAinterference by a paokaryotic Argonaute》启发,该文章介绍了TtAgo(Thermus thermophilus Argonaute)能以DNA为模板切DNA。
受到van der Oost的启发,2014年上半年,韩春雨团队开始着手实验,2个月之后,得出NgAgo可以做基因编辑工具。初步获得实验结果之后,韩春雨向《科学》杂志进行了投稿,在《科学》杂志审稿期间,韩春雨课题组不断对实验结果进行完善。2014年秋天,浙江大学沈啸也开始参与这项工作。经过《科学》杂志小半年的审稿,韩春雨的投稿最终被拒,估计这个时间大约在10月份。在补充了实验内容之后,2015年6月3日实验论文改投到《自然生物技术》,9个月之后,也就是大概2016年2月文章被接收,2016年5月2日在线发表。从开始研究,到论文见刊,前后大约两年的时间。
另外,要介绍一下John van der Oost。
John van der Oost目前就职于荷兰Wageningen University,2005年即开始研究CRISPR领域,是早期CRISPR的研究成员,与张锋和Jennifer Doudna都有合作,最新公开的专利显示John van der Oost也在Caribou Biosciences公司的发明人名单当中,该公司由Jennifer Doudna创建。
John van der Oost研究组的文章《DNA-guided DNAinterference by a paokaryotic Argonaute》,投稿时间是2013年7月30日,发表于2014年2月16日。
韩春雨和John van der Oost都申请了专利
先看John van der Oost围绕TtAgo申请且已公开的专利:
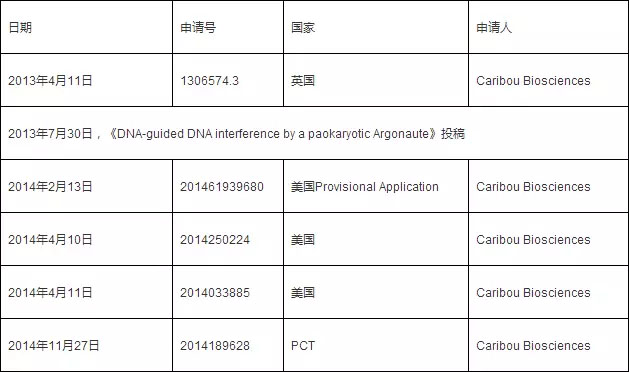
再看韩春雨申请的专利:

同样是在基因编辑领域的研究,同样成果都在世界顶级期刊发表。但是,对技术成果的保护却让人感觉意外。韩春雨的成果优于van der Oost的成果,但是,直到第二次投稿半年后才申请专利,专利发明人有两个,且第一发明人为浙江大学沈啸,还没有申请国外专利。而相比之下,van der Oost在投稿之前就申请了专利,且之后还进行了PCT国际申请。我想基因编辑领域关于CRISPR-Cas9的权属之争应该无人不晓,在这种情况下,这么重要的成果仍旧没有进行积极的专利布局。这反映的是我国研究人员对科研成果的态度和观念还停留在实验室,没有考虑市场应用,以及成果能给社会和人类带来什么样的福利。
因此要提醒:
1、发表论文了不等于你拥有了该项技术的所有权。我国诺奖得主屠呦呦发现的青蒿素药物举世闻名,但是该药物只进行了论文公开,而没有进行专利保护,国际药企可以任意使用青蒿素技术进行营利。这里不讲专利法规,请记住,有好的技术请先进行专利保护。
2、尽管申请专利了,但是不同的专利撰写人员,写出的专利水平参差不齐。暂不论权项布局合不合理,相比于van der Oost的20多项权利要求韩春雨发明的专利只有8项权利要求,本人在2011年参与过基因药投资项目,与国外类似动辄就几十上百项权利要求比,如此重要的技术仅有8项权利要求是远远不够的。专利质量的好坏对于后续实施和维权至关重要。
3、对于合作研发,当事人一定要约定好权属问题。对于韩春雨团队申请的专利,发明人来自两个高校,但是申请人只有一个,如果没有约定好,可能会对后续实施产生影响。且该专利许可费用如何分配,都是需要讨论的问题。
4、专利转化运用并不简单,相反非常复杂且成本很高。很多科研人员不仅不愿意对专利申请事物投入足够的精力和费用,而且更不愿意对专利转化运用投入人力、物力和财力。其实,专利转化的要求非常高,不仅需要相关的专业知识,还需要沟通、管理、谈判等诸多知识和技能,而科研单位和大学很少有这类人才。所以,并不是技术好就能转化,要找专业的团队。
NgAgo能够超越CRISPR吗?
文/科学网博客 朱猛进
NgAgo能够超越CRISPR吗?不止国内,有些老外也比较关注这个问题。世界上做基因组编辑方法和应用的实验室,差不多都有CRISPR-Cas9的成熟技术平台。CRISPR-Cas9编辑系统是已得到大家承认的成熟基因组编辑工具,而且CRISPR技术的优势不可小觑,有大牛撑它,它的发展和完善几乎汇聚了全世界基因组编辑实验室的资源,过去几年的发展速度令人惊叹。NgAgo 能够后来居上,超越 CRISPR吗?
从写个人主观评论的数量上来看,国外对NgAgo 的关注,感觉上似乎并没有国内这么热。简单搜列了一下,发现大多数评论都是客观地描述文章的结果或平行介绍NgAgo 和 CRISPR原理,带有个人主观色彩的评论不是特别多。下面摘录、整理、加工一些带有个人主观色彩的评论。David在其评论中认为,这是一个有趣的编辑系统,文章也值得一读,对于编辑效率,虽然缺乏严格的比较,但从文章给出的信息来判断,NgAgo和Cas9在编辑效率上应该是同级别的,至于NgAgo 能否替代 CRISPR,仍不能确定,唯一能确定的是这绝不是基因编辑的最后进展。Paul在其评论中给出的答案是:从任何角度,暂时都没有可能——“not going to immediately race ahead of CRISPR…not yet any way”,但他不得不承认NgAgo确实引起了人们的高度关注。他援引了韩春雨文章总结的4个特点,如果诚如文章所述的4点,那么NgAgo可能会比CRISPR更简洁,而且按照韩文章图5,NgAgo编辑效率确实有点牛。不过,他认为因为CRISPR已有大量的文章支持,所以NgAgo仅凭这篇文章还远远不能说明问题,对NgAgo的定论还得需要更多的文章和数据。读起来让人隐隐觉得有一种“too good to be true”的酸味道。最后,他说让我们来围观吧,接下来的几个月肯定会有大量井喷的后续文章。
于是,围观的家伙们真的来了——
路人甲——鹿死谁手,尚未可知,但大家要在公平的环境里竞争啊。(一看就是通晓业内潜规则的家伙,那么多做CRISPR的大牛,看来NgAgo的前景不妙啊,所以你们拉开场子打架可以,但要公平!公平!公平!)
CRISPR的死忠也来了,针对韩文章总结的4点一一开展了抨击——我绝不是瞎掰啊,我是根据Betteridge's law(该法则意思是对于任何以问号结尾的问题,都可以用no来回答)对NgAgo说no:(1)Church实验室的iPSC基因组测序结果说明CRISPR对错配也有Low tolerance,(2)误导(misguiding)?这是我听到基因组工程问题中最滑稽的命题,而且磷酸化的ssDNA那根本就不叫DNA好不好,那只能是看做对DNA破坏或感染,这两者(DNA damage 和DNA infection)对基因组操作来说都是不受欢迎的;(3)我从来不记得有人真正看到过sgRNA从Cas9中被替换出来,有木有?(4)谁说sgRNAs不好设计和合成?说这话的肯定是没做过基因组编辑的;(5)楼主你别帮人家瞎吹行不?我看图5中对HEK293T细胞的编辑效率低到不行,好不好?
路人乙——你不觉得这工具很牛掰,可以用来编辑成年人的基因么?(这脑洞开得有点大)
路人丙——你不觉得不需要PAM是个优点么?鄙人认为还未建立CRISPR平台的实验室和公司,选择NgAgo未尝不是一件好事。不过,从“前浪纷纷被后浪拍死的”节奏看,基因组编辑的发展速度令人眼花缭乱,NgAgo绝不会是最后的工具,我赌更好的工具最快年内就会出来。你赌不?两本阁楼杂志!
路人丁——你们这些傻X,为什么非要从自然界中找酶基因,难道你们不知道人工设计的酶更牛掰N倍么?我坚信最后终结你们这些浪费纳税人钱的,一定是人工设计出来的酶。(很愤青的样子)
路人午——对于投资了大量时间和资源在CRISPR上面的,不会轻易转到NgAgo上面,除非碰到100%不能解决PAM问题的情况,可能会尝试一下NgAgo。(貌似比较理性)
路人X——5′-P ssDNA不能通过质粒产生,意味着不能用质粒或病毒传递,只能合成和转染,转染是不可控的,这是NgAgo的一个大问题。
|