|
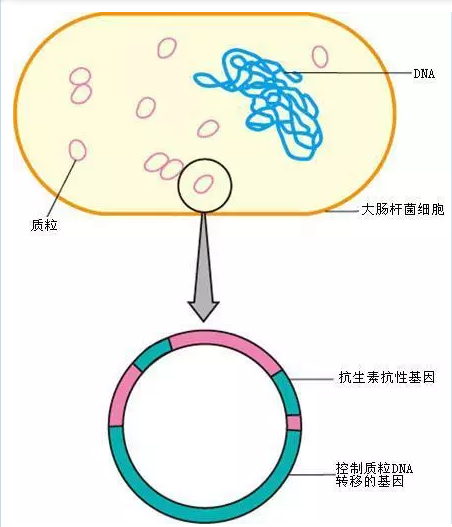
在我们的细胞实验中经常会用到质粒DNA,现在都用剂盒非常方便,而且菌体培养后,可以多管浓缩提取,提到的质粒量多,可以-20℃保存,以后用于酶切、转化等实验,可以提前跑个胶,只要不降解,就可以继续用,避免每次要用,都要培养一遍再提取一遍。
质粒DNA的提取
质粒多为一些双链、环状的DNA分子,是独立于细菌染色体之外进行复制和遗传的辅助性遗传单位。质粒是进行分子生物学实验操作,进行遗传工程改良物种等工作时最主要的DNA载体。
实验步骤
1.摇菌培养
1)将鉴定测序正确的克隆菌液涂在LB固体平板。
2)置于37℃恒温培养箱,培养12-17h,待长出菌落。
3) 灭菌15ml离心管内加入5ml含抗生素的LB液体培养基,编号标记。
4) 挑取单克隆菌团放置液体培养基,每个培养基放置1个菌落。
5) 37℃,180rpm,振荡培养过夜。
2.收获细菌并裂解
1) 离心扩增好的菌液,按说明书将菌液重悬,转入1.5ml离心管中。
2)用质粒小量抽提试剂盒,按说明书要求提取质粒。
3) 细菌高速离心1min,彻底去除上清。
4)加入250ulRB溶液,振荡器充分悬浮细菌。
5)加入250ulLB溶液。立即上下颠倒10次,使细菌裂解,室温,放置2min。
6)加入250ulNB溶液。立即上下颠倒10次,使之充分中和,室温,放置2min。
7)室温,1500rpm,高速离心15min。
8)将吸附柱放入收集管内,离心得到的上清转移至吸附柱,室温,15000rpm,高速离心30s。
9)弃废液,将吸附柱放入收集管,加入700ul WB溶液到吸附柱中,15000rpm,高速离心30s。
10)重复上一操作。
11)将吸附柱放入干净的1.5ml 离心管中,加30-50ul预热的Elution Buffer,室温,放置2min,高速离心1min。
12)样品进行电泳检测:1%琼脂糖凝胶电泳,上样量为2ul,紫外灯下观察,最明亮的带为超螺旋形式,可以在一定程度上表明提取质粒的纯度。
3.质粒的纯化
1)将之前提取好的质粒放入1.5ml离心管中,加入1/10体积的3mol/L 无菌乙酸钠溶液。
2)加入2倍体积的无水乙醇,放置于-20℃沉淀4-6h或过夜。
3)4℃,高速离心机14000rpm,离心20min.
4)弃去上清,70%乙醇洗2次。
5)空气干燥,可置超净工作台干燥。
6)加200ul无菌水溶液干燥后所得沉淀,即为质粒溶液。
7)紫外分光光度计测量质粒浓度和产量。
测量OD260和OD280的值:质粒DNA浓度=OD260×50×稀释倍数(μg/mL)。
10个常见问题
一.时间控制问题
裂解时间太长,加入溶液P2后裂解时间不应超过5 分钟;吸附时间不够;溶解时间不够都会导致质粒DNA提取实验失败。
二.大肠杆菌老化
建议涂布平板培养后,重新挑选新菌落进行液体培养。
三.质粒拷贝数低
由于使用低拷贝数载体引起的质粒DNA 提取量低,可更换具体相同功能的高拷贝数载体。
四.溶液使用不当
溶液P2、P3 在温度较低时可能出现浑浊,应置于37℃保温片刻直至溶解为清亮的溶液,才能使用。
五.吸附柱过载
不同产品中吸附柱吸附能力不同,如果需要提取的质粒量很大,请分多次提取。若用富集培养基,例如TB 或者 ×YT 菌液体积必须减少;若质粒或宿主菌是非常高的拷贝数或生长率,则需调整LB 培养液体积。
六.质粒未全部溶解
洗脱溶解质粒时,可适当加温或延长溶解时间。
七.乙醇残留
漂洗液洗涤后应离心尽量去除残留液体,树脂型试剂盒漂洗后应晾干树脂,再加入洗脱缓冲液。
八.洗脱液加入位置不正确
洗脱液应加在硅胶膜中心部位以确保洗脱液会完全覆盖硅胶膜的表面达到最大洗脱效率。
九.洗脱液不合适
DNA 只在低盐溶液中才能被洗脱。洗脱效率取决于pH 值。最大洗脱效率在pH7.0~ 8.5 间。当用水洗脱时确保其 pH 值在此范围内,如果pH 过低可能性导致洗脱量低。洗脱时将灭菌蒸馏水或洗脱缓冲液加暖至 60 ℃后使用有利于提高洗脱效率。
十.洗脱体积太小
洗脱体积对来回收率有一定影响。随着洗脱体积的增大回收率增高,但产品浓度降低。为了得到较高的回收率可以增大洗脱体积。
技术咨询热线:18702955082(微信同号)
|